La interacción levadura-micorriza como estrategia para la producción de tomate
DOI:
Palabras clave:
Funneliformis mosseae, Candida saitoana, Saccharomyces eubayanus, Tausonia pullulans, agricultura sustentableResumen
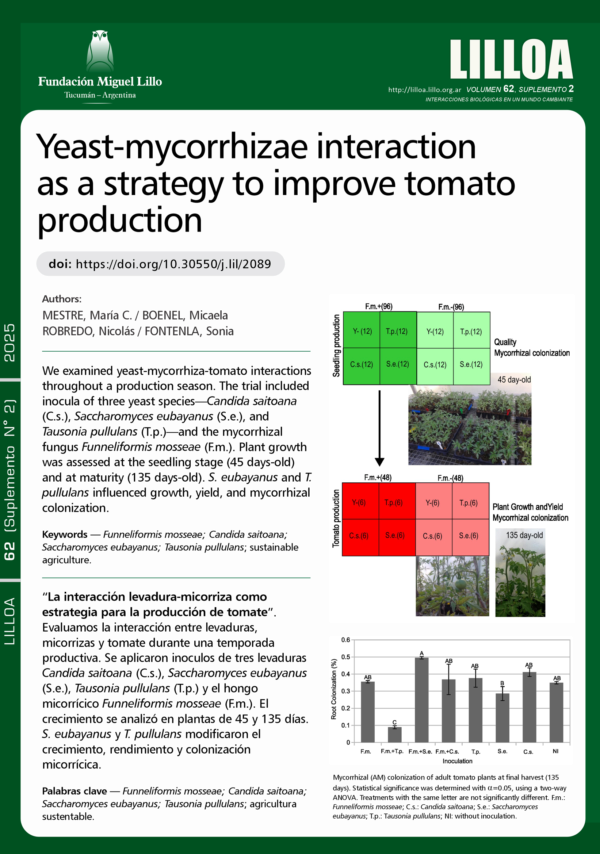
La inoculación con microorganismos promotores del crecimiento vegetal, como bacterias, hongos micorrícicos y levaduras del suelo, puede tener un rol prometedor en la producción agrícola sostenible. Este estudio evaluó el potencial de hongos micorrícicos y levaduras patagónicas para mejorar el crecimiento y la productividad de plantas de tomate (Lycopersicum esculentum var. platense) durante la temporada de producción en Patagonia. Se llevó a cabo un experimento en invernadero, en el cual las plantas fueron inoculadas con el hongo micorrícico Funneliformis mosseae y las levaduras Candida saitoana, Saccharomyces eubayanus o Tausonia pullulans. Ninguna de las plantulas de 45 días presentaban colonización micorrícica, aunque la inoculación con F. mosseae influyó significativamente en el crecimiento de las plántulas. Al final de la temporada de producción (plantas de 135 días de edad), todas las plantas presentaron colonización micorrícica, y aquellas inoculadas con F. mosseae mostraron un aumento en el crecimiento y el rendimiento. La inoculación con S. eubayanus mejoró tanto el rendimiento de las plantas como la colonización micorrícica. En contraste, la co-inoculación con T. pullulans y F. mosseae resultó perjudicial para la colonización micorrícica. Sin embargo, T. pullulans mejoró de forma independiente el crecimiento y el rendimiento de las plantas, lo que sugiere que esta levadura puede beneficiar la producción de tomate sin depender de las asociaciones micorrícicas. Estos resultados destacan las complejas interacciones entre hongos micorrícicos y levaduras del suelo en sistemas agronómicos
Descargas
Citas
Aguilera, P., Becerra, N., Alvear, M., Ortiz, N., Turrini, A., Azcón-Aguilar, C., ... & Borie, F. (2022). Arbuscular mycorrhizal fungi from acidic soils favors production of tomatoes and lycopene concentration. Journal of the Science of Food and Agriculture102 (6): 2352-2358. https://doi.org/10.1002/jsfa.11573
Biel, C., Camprubí, A., Lovato, P. E. & Calvet, C. (2021). On-farm reduced irrigation and fertilizer doses, and arbuscular mycorrhizal fungal inoculation improve water productivity in tomato production. Scientia Horticulturae 288: 110337. https://doi.org/10.1016/j.scienta.2021.110337
Bonfante, P. & Requena, N. (2011). Dating in the dark: how roots respond to fungal signals to establish arbuscular mycorrhizal symbiosis. Current opinion in plant biology 14 (4): 451-457. https://doi.org/10.1016/j.pbi.2011.03.014
Carvajal, M., Godoy, L., Gebauer, M., Catrileo, D. & Albornoz, F. (2024). Screening for indole-3-acetic acid synthesis and 1-aminocyclopropane-carboxylate deaminase activity in soil yeasts from Chile uncovers Solicoccozyma aeria as an effective plant growth promoter. Plant and Soil 496 (1): 83-93. https://doi.org/10.1007/s11104-023-05906-x
De Mendiburu, F. (2020). Agricolae tutorial (Version 1.3-2)—Statistical procedures for agricultural research.
Dejana L., Ramírez-Serrano, B., Rivero, J., Gamir, J., López-Ráez, J. A. & Pozo, M. J. (2022) Phosphorus availability drives mycorrhiza induced resistance in tomato. Frontiers in Plant Science 13: 1060926. https://doi.org/10.3389/fpls.2022.1060926
Fernandez, N. V., Mestre, M. C., Marchelli, P. & Fontenla, S. B. (2012). Yeast and yeast-like fungi associated with dry indehiscent fruits of Nothofagus nervosa in Patagonia, Argentina. FEMS microbiology ecology 80 (1): 179-192. https://doi.org/10.1111/j.1574- 6941.2011.01287.x. PMID:22224476
Fox, J. & Weisberg, S. (2018). An R companion to applied regression. Sage publications.
Fracchia, S., Godeas, A., Scervino, J. M., Sampedro, I., Ocampo, J. A. & Garc?a-Romera, I. (2003). Interaction between the soil yeast Rhodotorula mucilaginosa and the arbuscular mycorrhizal fungi Glomus mosseae and Gigaspora rosea. Soil Biology and Biochemistry 35 (5): 701-707. http://dx.doi.org/10.1016/S0038-0717(03)00086-5
Gallegos-Cedillo, V. M., Diánez, F., Nájera, C. & Santos, M. (2021). Plant agronomic features can predict quality and field performance: a bibliometric analysis. Agronomy 11 (11): 2305. https://doi.org/10.3390/agronomy11112305
Gollner, M. J., Püschel, D., Rydlová, J. & Vosátka, M. (2006). Effect of inoculation with soil yeasts on mycorrhizal symbiosis of maize. Pedobiologia 50 (4): 341-345. https://doi.org/10.1016/j.pedobi.2006.06.002
Hartig, F. (2020). DHARMa: residual diagnostics for hierarchical (multi-level/mixed) regression models. R Packag version 020.
Jiang, C., Johkan, M., Hohjo, M., Tsukagoshi, S. & Maruo, T. (2017). A correlation analysis on chlorophyll content and SPAD value in tomato leaves. HortResearch 71 (71): 37-42. http://doi.org/10.20776/S18808824-71-P37
Lidoy, J., López-García, Á., Amate, C., García, J. M., Flors, V., García-Garrido, J. M.,.. & Pozo, M. J. (2023). Regulation of mycorrhizal colonization under stress in tomato depends on symbiotic efficiency. Environmental and Experimental Botany 215: 105479. https://doi.org/10.1016/j.envexpbot.2023.105479
McGonigle, T. P., Miller, M. H., Evans, D. G., Fairchild, G. L. & Swan, J. A. (1990). A new method which gives an objective measure of colonization of roots by vesicular-arbuscular mycorrhizal fungi. New phytologist 115 (3): 495-501. https://doi.org/10.1111/j.1469-8137.1990.tb00476.x
Mestre, M. C., Fontenla, S. & Rosa, C. A. (2014). Ecology of cultivable yeasts in pristine forests in northern Patagonia (Argentina) influenced by different environmental factors. Canadian journal of microbiology 60 (6): 371-382. https://doi.org/10.1139/cjm-2013-0897
Mestre, M. C., Fontenla, S., Bruzone, M. C., Fernández, N. V. & Dames, J. (2016). Detection of plant growth enhancing features in psychrotolerant yeasts from Patagonia (Argentina). Journal of basic microbiology 56 (10): 1-9. https://doi.org/1098-1106. 10.1002/jobm.201500728
Mestre, M. C., Severino, M. E. & Fontenla, S. (2021). Evaluation and selection of culture media for the detection of auxin-like compounds and phosphate solubilization on soil yeasts. Revista argentina de microbiología 53 (1): 1-10. https://doi.org/10.1016/j.ram.2024.12.004
Mestre, M. C., Tamayo Navarrete, M. I. & García Garrido, J. M. (2022). Exploring the yeast-mycorrhiza-plant interaction: Saccharomyces eubayanus negative effects on arbuscular mycorrhizal formation in tomato plants. Plant and Soil 479 (1): 529-542. https://doi.org/10.1007/s11104-022-05538-7
Mestre, M. C., Rosa, C. A., Safar, S. V., Libkind, D. & Fontenla, S. B. (2011). Yeast communities associated with the bulk-soil, rhizosphere and ectomycorrhizosphere of a Nothofagus pumilio forest in northwestern Patagonia, Argentina. FEMS microbiology ecology 78 (3): 531-541. https://doi.org/10.1111/j.1574-6941.2011.01183.x
Mohamed, H. M. (2015). Effect of arbuscular mycorrhizal fungus (Glomus mosseae) and soil yeasts interaction on root nodulation, N-fixation and growth of faba bean (Vichia faba). Malaysian Journal of Soil Science 19: 157-168.
Nimsi, K. A., Manjusha, K., Kathiresan, K. & Arya, H. (2023). Plant growth-promoting yeasts (PGPY), the lates t entrant for use in sustainable agriculture: a review. Journal of Applied Microbiology 134 (2): 1-11. https://doi.org/10.1093/jambio/lxac088
Phillips, J. M. & Hayman, D. S. (1970). Improved procedures for clearing roots and staining parasitic and vesicular-arbuscular mycorrhizal fungi for rapid assessment of infection. Transactions of the British mycological Society 55 (1): 158-IN18.
Radi?, D., Karli?i?, V., ?or?evi?, J., Jovi?i?-Petrovi?, J., Kljujev, I., Lalevi?, B. & Rai?evi?, V. (2022). Soil yeasts promoting plant growth: benefits for the development of common wheat and white mustard. Zemdirbyste-Agriculture 109 (1): 27-34. https://doi.org/10.13080/z-a.2022.109.004
Sampedro, I., Aranda, E., Scervino, J. M., Fracchia, S., García-Romera, I., Ocampo, J. A. & Godeas, A. (2004). Improvement by soil yeasts of arbuscular mycorrhizal symbiosis of soybean (Glycine max) colonized by Glomus mosseae. Mycorrhiza 14: 229-234. https://doi.org/10.1007/s00572-003-0285-y
Sarabia, M., Jakobsen, I., Grønlund, M., Carreon-Abud, Y. & Larsen, J. (2018). Rhizosphere yeasts improve P uptake of a maize arbuscular mycorrhizal association. Applied Soil Ecology 125: 18-25. https://doi.org/10.1016/j.apsoil.2017.12.012
Smith, S. E. & Read, D. J. (2008). Mycorrhizal symbiosis. Academic press.
Soval-Villa, M., Wood, C. W. & Guertal, E. A. (2002). Tomato leaf chlorophyll meter readings as affected by variety, nitrogen form, and nighttime nutrient solution strength. Journal of plant nutrition 25 (10): 2129-2142. https://doi.org/10.1081/PLN-120014065
Van Der Heijden, M. G. & Horton, T. R. (2009). Socialism in soil? The importance of mycorrhizal fungal networks for facilitation in natural ecosystems. Journal of ecology 97 (6): 1139-1150. https://doi.org/10.1111/j.1365-2745.2009.01570.x
Vargas, M. F., Mestre, M. V., Vergara, C., Maturano, P., Petrignani, D., Pesce, V. & Vazquez, F. (2024). Residual brewer’s Saccharomyces cerevisiae yeasts as biofertilizers in horticultural seedlings: towards a sustainable industry and agriculture. Frontiers in Industrial Microbiology 2: 1360263. https://doi.org/10.3389/finmi.2024.1360263
Venegas Jaque, P., Cardozo, A., Sisón Cáceres, L. A. & Gasparetti, A. F. (2021). Elaboración de Biopreparados a partir de microorganismos del bosque para la producción frutihortícola de la Comarca Andina del paralelo 42°. http://hdl.handle.net/20.500.12123/9881
Wezel, A., Casagrande, M., Celette, F., Vian, J. F., Ferrer, A. & Peigné, J. (2014). Agroecological practices for sustainable agriculture. A review. Agronomy for sustainable development 34 (1): 1-20. ff10.1007/s13593-013-0180-7ff.
Descargas
Publicado
Cómo citar
Número
Sección
Licencia
Derechos de autor 2025 Lilloa

Esta obra está bajo una licencia internacional Creative Commons Atribución-NoComercial-CompartirIgual 4.0.